2026年、米国麻薬取締局(DEA)がシロシビンの研究用生産量を67%増加させる歴史的決定を下しました。うつ病やPTSDの新たな治療法として世界中で注目を集めるサイケデリック療法。本記事では、DEA最終規則の詳細と臨床試験の最新動向、そしてFDA承認に向けた今後の展望について紹介します。
DEA は2026年にシロシビンの研究用生産量を67%増加させた
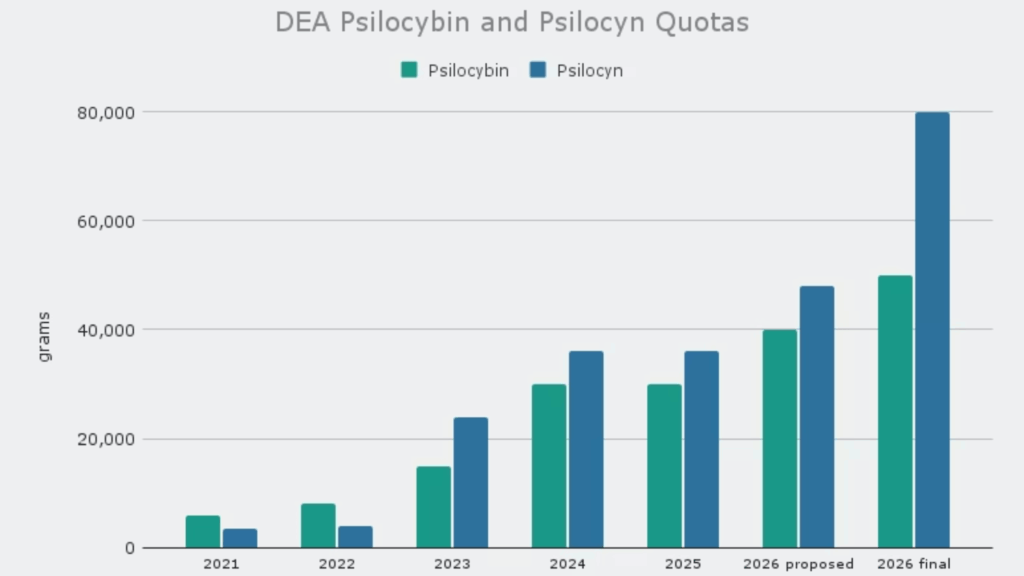
2026年1月5日、DEAは連邦官報において、規制物質の年間生産割当量(APQ:Aggregate Production Quota)に関する最終規則を公表しました。この規則の中で最も注目すべきは、シロシビンをはじめとするサイケデリック物質の生産量が大幅に引き上げられた点です。
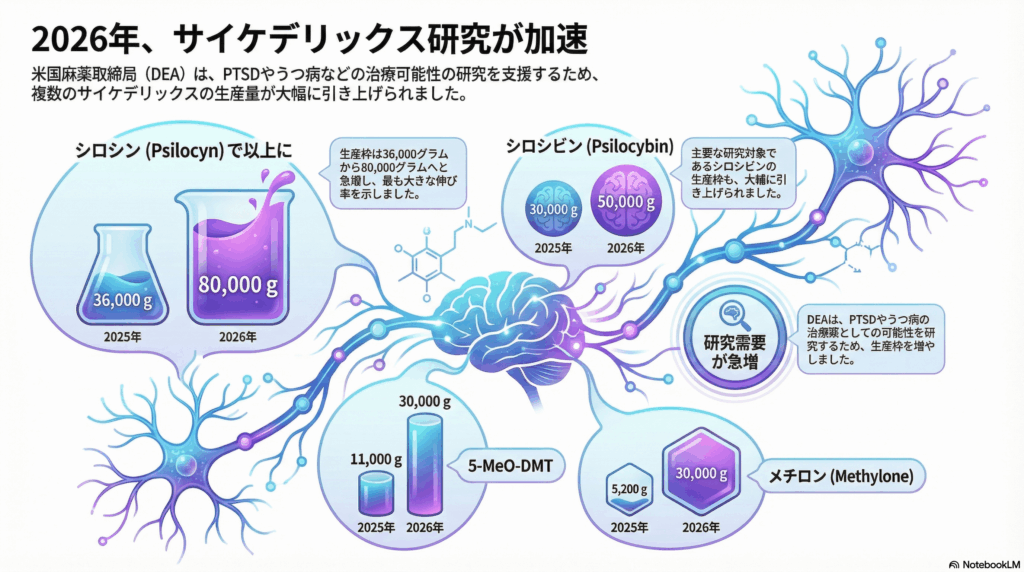
具体的な数値を見ると、その変化の大きさがよくわかります。シロシビンの生産割当量は2025年の30,000グラムから2026年には50,000グラムへと約67%増加しました。さらに驚くべきことに、シロシンについては36,000グラムから80,000グラムへと2倍以上に拡大されています。
DEAはこれらの増加について、パブリックコメント(一般からの意見募集)を受けて当初の提案値からさらに上方修正したと説明しています。11月に発表された草案では、シロシビンは40,000グラム、シロシンは48,000グラムでしたが、最終規則ではそれぞれ50,000グラム、80,000グラムまで引き上げられました。
他のサイケデリック物質も軒並み増加
シロシビンだけでなく、他のサイケデリック物質についても研究用生産量が増加しています。DMT(ジメチルトリプタミン)は20,000グラムから25,000グラムへ、5-MeO-DMT(ヒキガエル由来のサイケデリック物質)は11,000グラムから30,000グラムへと大幅に増加しました。
特に注目すべきは、メチロン(MDMAに類似した化合物)の変化です。2021年にはわずか40グラムだった生産割当量が、2026年には30,000グラムまで増加しました。これは4年間で実に750倍という驚異的な伸びを示しています。
こうした増加は、サイケデリック物質を用いた臨床試験が急速に拡大していることを反映しています。DEAは連邦官報の中で、これらの物質が「PTSDやうつ病などの症状の潜在的治療法」として研究されていることを認めており、研究需要の高まりに対応する姿勢を明確にしました。
なぜDEAはサイケデリック研究を支援しているのか
この急激な生産量増加の背景には、サイケデリック療法に対する科学的関心の高まりがあります。DEAはあくまで規制当局であり、サイケデリック物質を推進する立場ではありません。しかし、合法的な研究活動を支援する責務を負っています。
DEAが生産割当量を設定する際には、FDA(食品医薬品局)をはじめとする連邦保健機関からの情報、研究機関からの需要予測、そして法的な輸出要件などを総合的に考慮します。連邦官報には「これらの割当量は、米国の医療・科学・研究・産業ニーズを満たすために必要な量を反映している」と明記されています。
近年のサイケデリック研究の活性化は、FDAが付与した「画期的治療薬指定(Breakthrough Therapy Designation)」と密接に関連しています。この指定は、既存の治療法を大幅に改善する可能性のある新薬の開発を加速させるためのもので、サイケデリック分野では複数の化合物がこの指定を受けています。
画期的治療薬指定を受けたサイケデリック物質
FDAは2018年にCOMPASS Pathways社のシロシビン製剤に対して、治療抵抗性うつ病の治療薬としての画期的治療薬指定を付与しました。翌2019年にはUsona Instituteのシロシビンにも大うつ病性障害(MDD)を対象として同様の指定が与えられています。
さらに2024年には、Cybin社が開発する重水素化シロシビンアナログ「CYB003」も大うつ病性障害の補助療法として画期的治療薬指定を取得しました。第2相臨床試験では、16mgを2回投与された参加者の75%が4ヶ月後に寛解を達成したという驚異的な結果が報告されています。
これらの指定は、サイケデリック療法が従来の抗うつ薬と比べて大きな優位性を持つ可能性を示唆しています。実際、標準的なSSRI(選択的セロトニン再取り込み阻害薬)では寛解に至らない患者が多い中、シロシビン療法は単回または数回の投与で持続的な効果をもたらす可能性が示されているのです。
臨床試験の最新動向:第3相試験で初の成功

2025年、サイケデリック研究は新たなマイルストーンを達成しました。COMPASS Pathways社が実施した第3相臨床試験「COMP005」において、COMP360(合成シロシビン製剤)が治療抵抗性うつ病の治療において主要評価項目を達成したのです。
この試験では、米国32施設で258名の治療抵抗性うつ病患者を対象に、25mgのCOMP360単回投与とプラセボの比較が行われました。結果として、投与6週間後のモンゴメリー・アスベルグうつ病評価尺度(MADRS)スコアの変化において、COMP360群はプラセボ群と比較して統計的に高度に有意な改善を示しました。
これは第3相臨床試験で有効性データが報告された初めての合成シロシビン製剤であり、サイケデリック療法の歴史において画期的な出来事といえます。COMPASS Pathways社はこのデータをFDAと協議する予定であり、承認申請に向けた重要な一歩となりました。
サイケデリック療法の特徴:従来薬との違い
サイケデリック療法が注目される理由は、その独特な治療モデルにあります。従来の抗うつ薬は毎日服用する必要があり、効果が現れるまでに数週間かかることが一般的です。一方、シロシビン療法は通常1〜3回のセッションで構成され、各セッションでは心理療法士の支援のもとで薬物体験が行われます。
研究によれば、シロシビンは単に神経伝達物質のバランスを変えるだけでなく、脳の柔軟性を高め、新たな視点や洞察を促す可能性があります。多くの参加者が「神秘的体験」と呼ばれる深い意識状態を報告しており、この体験の強度が長期的な治療効果と相関することも示されています。
また、シロシビンは感情的共感の増加、マインドフルネス能力の向上、回避行動の減少といった効果も報告されています。これらの変化は、PTSDや依存症など、トラウマに関連する精神疾患の治療において特に重要な意味を持つ可能性があります。
規制の壁:連邦法とのギャップ

こうした科学的進展にもかかわらず、シロシビンは依然として連邦法上のスケジュールI物質に分類されています。スケジュールIとは「医療用途が認められておらず、乱用の可能性が高い」とされる物質のカテゴリーであり、これはヘロインやLSDと同じ分類です。
この分類は1970年の規制物質法によって定められ、それ以降約50年にわたって厳格に維持されてきました。しかし、近年の研究はこの分類が科学的実態と乖離していることを示唆しています。FDAが画期的治療薬指定を付与したこと自体が、シロシビンの医療的可能性を連邦政府が認識していることの証左といえるでしょう。
一方で、一部の州では独自の規制緩和が進んでいます。オレゴン州は2020年に成人向けのシロシビン療法を合法化した最初の州となり、コロラド州も2022年に続きました。2024年にはオーストラリアが精神科医によるシロシビン処方を認める最初の国となるなど、国際的にも規制緩和の動きが広がっています。
連邦政府の動き:VAによる研究資金提供
2024年1月、退役軍人省(VA)は画期的な発表を行いました。MDMAとシロシビンを用いたPTSDおよびうつ病治療の研究に対して、初めて資金を提供する意向を示したのです。これは1960年代以来初めてのことであり、連邦政府のサイケデリック研究に対する姿勢の転換を示す重要な動きでした。
VAがこの決定を下した背景には、退役軍人の深刻な精神健康問題があります。VA患者の14%がPTSDを抱えており、30%が何らかの精神疾患を持っているとされています。従来の治療法では十分な効果が得られないケースも多く、新たな治療選択肢への期待が高まっています。
ジョンズ・ホプキンス大学の研究では、シロシビン療法が支持的心理療法と組み合わせることで、うつ症状を最大12ヶ月にわたって緩和できることが示されました。また、別の査読付き研究では、MDMAを用いたPTSD治療において参加者の86%が「臨床的に意味のある効果」を経験したと報告されています。
今後の課題と展望

サイケデリック療法の実用化に向けては、まだいくつかの課題が残されています。まず、臨床試験のデザインにおける課題があります。FDAは2024年にサイケデリック臨床試験に関する初のドラフトガイダンスを公表しましたが、その中でプラセボ対照の困難さ(サイケデリック体験は明らかに識別可能であるため、真の盲検化が難しい)や、期待効果の影響などが指摘されています。
また、実際の医療現場への導入においては、訓練を受けた療法士の確保、専用施設の整備、そして保険適用の問題など、実務的な課題も山積しています。現在のサイケデリック療法は集中的な心理療法プロトコルを必要とするため、日常的な診療への統合には時間がかかる可能性があります。
コスト面も大きな障壁です。オレゴン州では合法化されたものの、1回の治療に数千ドルかかることがあり、保険適用がなければ一部の富裕層にしかアクセスできない状況です。この課題を解決するため、一部の団体は財政支援プログラムを立ち上げていますが、広範なアクセスの実現にはまだ時間がかかりそうです。
製薬企業による開発競争
こうした課題がある一方で、製薬企業によるサイケデリック療法の開発競争は激化しています。COMPASS Pathways、Cybin、Usona Instituteなど複数の企業・団体が第2相・第3相臨床試験を進めており、今後1〜2年以内にFDAへの承認申請が行われる可能性があります。
特にCOMPASS Pathwaysは、第3相試験で主要評価項目を達成した最初の企業として、承認レースをリードしています。同社のCOMP360は英国でもILAP(革新的ライセンスおよびアクセス経路)指定を受けており、グローバルな承認取得に向けた動きが加速しています。
Cybin社は、従来のシロシビンよりも作用時間が短く予測可能性が高い「次世代」サイケデリック化合物の開発を進めています。これにより、臨床使用における実用性が向上する可能性があり、医療現場への導入が容易になることが期待されています。
まとめ:DEAの決定が示すサイケデリック研究の新時代
DEAによる2026年のシロシビン生産割当量67%増加は、サイケデリック研究が新たな段階に入ったことを象徴しています。わずか数年前まで研究が事実上停止していた分野が、今や連邦政府の支援のもとで急速に発展しつつあるのです。
第3相臨床試験での成功、画期的治療薬指定の拡大、そして退役軍人省による研究資金提供など、2024年から2025年にかけてのサイケデリック療法をめぐる動きは、この分野の将来に対する楽観的な見通しを強めています。
もちろん、FDA承認の獲得、医療現場への統合、そして広範なアクセスの実現に向けては、まだ多くのハードルが残されています。しかし、うつ病やPTSDなど既存の治療法では十分に対応できない精神疾患に苦しむ多くの人々にとって、サイケデリック療法は新たな希望となる可能性を秘めています。
DEAの決定は、規制当局がこうした可能性を認識し、科学的研究を支援する意思を持っていることの表れです。今後も臨床試験の結果や規制の動向を注視しながら、サイケデリック療法の発展を見守っていく必要があるでしょう。
Jaeger, K. (2026, January 5). DEA boosts legal production levels for psychedelics like psilocybin and DMT in final rule for 2026. Marijuana Moment. https://www.marijuanamoment.net/dea-boosts-legal-production-levels-for-psychedelics-like-psilocybin-and-dmt-in-final-rule-for-2026/
本記事は情報提供のみを目的としており、医療アドバイスではありません。
精神的・身体的な問題を抱えている方は、必ず医療専門家にご相談ください。
また、日本国内でのサイケデリック物質の所持・使用は法律で禁止されています。



